Nobelpreis für Physiologie oder Medizin 2019
Die Nobelversammlung des Karolinska Institutet hat heute beschlossen, den diesjährigen Nobelpreis in der Kategorie Physiologie oder Medizin gemeinsam an drei Zellforscher zu verleihen: Die US-Amerikaner William G. Kaelin Jr. und Gregg L. Semenza sowie der Brite Peter J. Ratcliffe werden für ihre Entdeckungen zu Zellreaktionen auf Sauerstoff geehrt.

Der Nobelpreis für Physiologie oder Medizin 2019 wird gemeinsam an William G. Kaelin Jr., Sir Peter J. Ratcliffe und Gregg L. Semenza verliehen. Die Forscher haben herausgefunden, wie Zellen die Sauerstoffverfügbarkeit wahrnehmen und sich an diese anpassen.
Tiere benötigen Sauerstoff, um Nahrung in nützliche Energie umzuwandeln. Die grundlegende Bedeutung von Sauerstoff ist seit Jahrhunderten bekannt – doch wie sich Zellen an Veränderungen des Sauerstoffgehalts anpassen, ist seit langem unbekannt. William G. Kaelin Jr., Sir Peter J. Ratcliffe und Gregg L. Semenza entdeckten, wie Zellen die sich verändernde Sauerstoffverfügbarkeit erkennen und sich anpassen können. Sie identifizierten molekulare Mechanismen, die die Aktivität von Genen als Reaktion auf unterschiedliche Sauerstoffkonzentrationen regulieren.
Die bahnbrechenden Entdeckungen der diesjährigen Nobelpreisträger zeigen den Mechanismus für einen der wichtigsten Anpassungsprozesse des Lebens. Sie bilden die Grundlage für unser Verständnis, wie Sauerstoffspiegel den Zellstoffwechsel und die physiologische Funktion beeinflussen. Ihre Entdeckungen haben auch den Weg für vielversprechende neue Strategien zur Bekämpfung von Anämie, Krebs und vielen anderen Krankheiten geebnet.
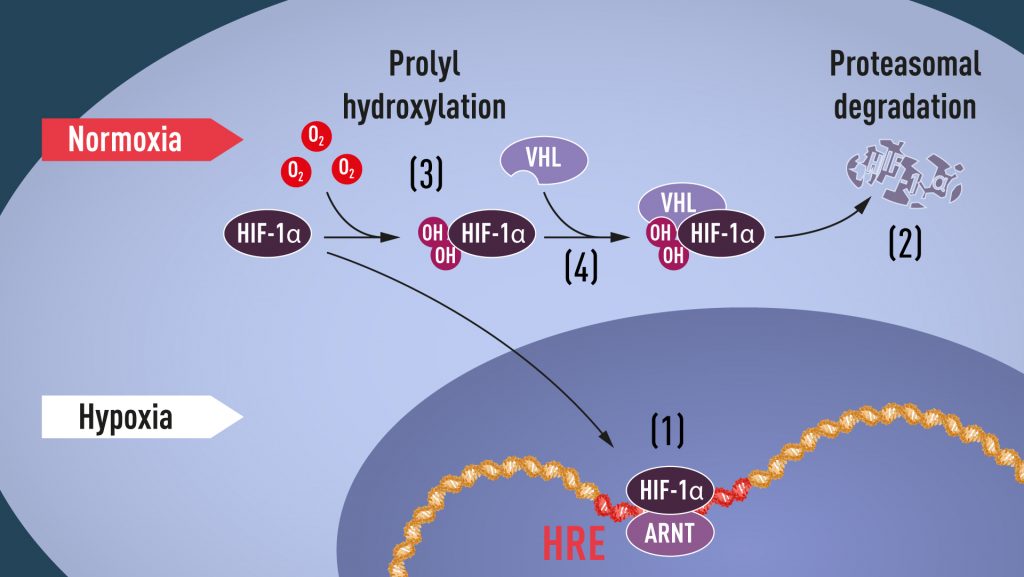
Wenn der Sauerstoffgehalt niedrig ist (Hypoxie), wird HIF-1α vor Abbau geschützt und sammelt sich im Zellkern an, wo es mit ARNT assoziiert und an spezifische DNA-Sequenzen (HRE) in hypoxie-regulierten Genen bindet (1). Bei normalen Sauerstoffgehalten wird HIF-1α durch das Proteasom (2) schnell abgebaut. Sauerstoff reguliert den Abbauprozess durch Addition von Hydroxylgruppen (OH) an HIF-1α (3). Das VHL-Protein kann dann einen Komplex mit HIF-1α erkennen und bilden, der in sauerstoffabhängiger Weise zu dessen Abbau führt (4).
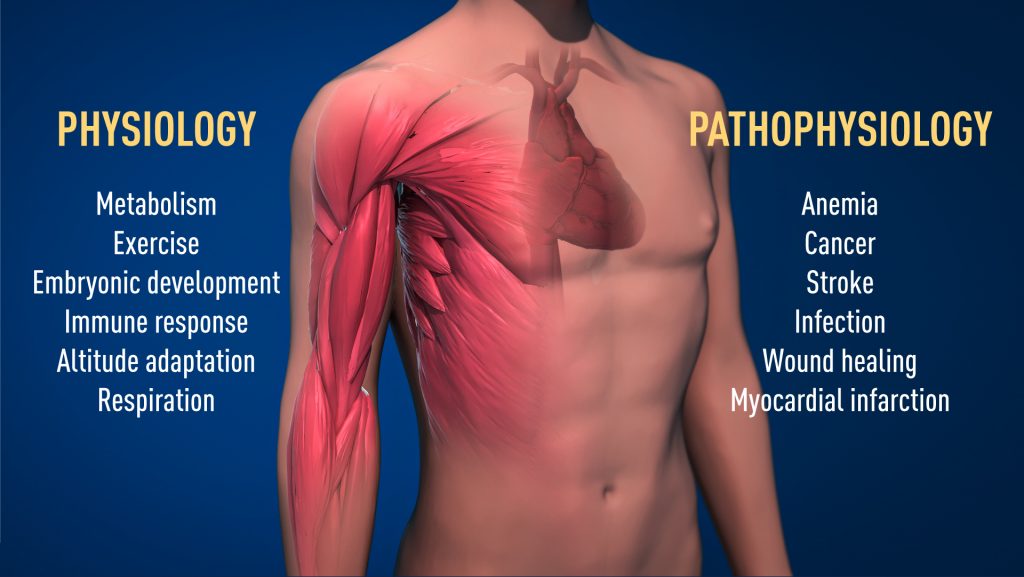
Abbildung 2. Der prämierte Mechanismus für die Sauerstoffmessung ist in der Physiologie von grundlegender Bedeutung, z. B. für unseren Stoffwechsel, die Immunantwort und die Fähigkeit, sich an sportliche Aktivitäten anzupassen. Viele pathologische Prozesse sind ebenfalls betroffen. Es werden intensive Anstrengungen unternommen, um neue Medikamente zu entwickeln, die die sauerstoffregulierten Mechanismen zur Behandlung von Anämie, Krebs und anderen Krankheiten entweder hemmen oder aktivieren können.
William G. Kaelin Jr. wurde 1957 in New York geboren. Er promovierte an der Duke University in Durham. Seine Ausbildung zum Facharzt für Innere Medizin und Onkologie absolvierte er an der Johns Hopkins University in Baltimore und am Dana-Farber Cancer Institute in Boston. Er gründete sein eigenes Forschungslabor am Dana-Farber Cancer Institute und wurde 2002 ordentlicher Professor an der Harvard Medical School. Seit 1998 ist er Investigator am Howard Hughes Medical Institute.
Sir Peter J. Ratcliffe wurde 1954 in Lancashire, Großbritannien, geboren. Er studierte Medizin am Gonville und Caius College an der Cambridge University und absolvierte seine Fachausbildung in Nephrologie in Oxford. Er gründete eine unabhängige Forschungsgruppe an der Universität Oxford und wurde 1996 ordentlicher Professor. Er ist Direktor für klinische Forschung am Francis Crick Institute in London, Direktor des Target Discovery Institute in Oxford und Mitglied des Ludwig Institute for Cancer Research.
Gregg L. Semenza wurde 1956 in New York geboren. Er erhielt seinen B.A. in Biologie von der Harvard University, Boston. 1984 promovierte er an der University of Pennsylvania an der School of Medicine in Philadelphia und wurde an der Duke University in Durham zum Facharzt für Pädiatrie ausgebildet. Er promovierte an der Johns Hopkins University in Baltimore und gründete dort eine unabhängige Forschungsgruppe. 1999 wurde er ordentlicher Professor an der Johns Hopkins University und ist seit 2003 Direktor des Vascular Research Program am Johns Hopkins Institute for Cell Engineering.

von links: Gregg L. Semenza, Peter J. Ratcliffe und William G. Kaelin Jr.
Wichtige Veröffentlichungen
Semenza, G.L, Nejfelt, M.K., Chi, S.M. & Antonarakis, S.E. (1991). Hypoxia-inducible nuclear factors bind to an enhancer element located 3’ to the human erythropoietin gene. Proc Natl Acad Sci USA, 88, 5680-5684
Wang, G.L., Jiang, B.-H., Rue, E.A. & Semenza, G.L. (1995). Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci USA, 92, 5510-5514
Maxwell, P.H., Wiesener, M.S., Chang, G.-W., Clifford, S.C., Vaux, E.C., Cockman, M.E., Wykoff, C.C., Pugh, C.W., Maher, E.R. & Ratcliffe, P.J. (1999). The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature, 399, 271-275
Mircea, I., Kondo, K., Yang, H., Kim, W., Valiando, J., Ohh, M., Salic, A., Asara, J.M., Lane, W.S. & Kaelin Jr., W.G. (2001) HIFa targeted for VHL-mediated destruction by proline hydroxylation: Implications for O2 sensing. Science, 292, 464-468
Jakkola, P., Mole, D.R., Tian, Y.-M., Wilson, M.I., Gielbert, J., Gaskell, S.J., von Kriegsheim, A., Heberstreit, H.F., Mukherji, M., Schofield, C.J., Maxwell, P.H., Pugh, C.W. & Ratcliffe, P.J. (2001). Targeting of HIF-α to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science, 292, 468-472
Quelle und Illustrationen: © The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén



